
Nitryfikacja, kluczowy proces w świecie przyrody.
Azot zaraz po węglu jest najważniejszym makroelementem w świecie przyrody. Jego nieprzerwany obieg (cykl azotowy) decyduje o życiu na ziemi. Cykl azotowy ma również niepodważalne znaczenie dla zdrowego funkcjonowania akwarium. Najważniejszym etapem cyku azotowego jest nitryfikacja, która odgrywa kluczową rolę w cyklu azotowym ekosystemów lądowych i wodnych, przekształcając najbardziej zredukowaną formę azotu, NH3/NH4+do najbardziej utlenionej formy NO3–[1].
Bakterie cyklu azotowego – nitryfikanty.
Bakterie, które zdolne są do utleniania jonów amonowych do azotynów i dalej do azotanów nazywamy nitryfikatorami, natomiast przemiany, które zachodzą – nitryfikacją. Drobnoustroje przeprowadzające nitryfikację zużywają energię uzyskaną podczas utleniania amoniaku i azotynów do syntezy masy organicznej z dwutlenku węgla i wody. Proces ten nazywa się chemosyntezą, natomiast drobnoustroje te nazywamy ogólnie chemoautotrofami[2]. Utlenianie amoniaku do azotynu dokonuje się przy udziale bakterii Nitrosomonas i Nitrosospira. Charakterystyczną cechą tych mikroorganizmów jest wzrost na granicy faz, zwykle na powierzchni ciał stałych. W glebie występują na powierzchni ziaren piasku i grudek ziemi. Są bardzo odporne na wysuszenie, przykładowo w suchej glebie mogą przetrwać przez kilka lat w stanie życia utajonego (anabiozy). Wytwarzany przez te bakterie kwas azotawy jest dla nich toksyczny stężenie 0,3M hamuje chemosyntezę o 30%. Gromadzący się w komórkach NO2– musi więc być czynnie wydalany, przy czym zużywane jest sporo energii. Dlatego też wydajność chemosyntezy np. u Nitrosomonas jest nieduża i dla młodych kolonii jest to do 20%, u starszych do około 7%. Utlenianie azotynu do azotanu dokonuje się przy udziale bakterii Nitrobacter, Nitrococcus. Nieco słabiej wiążą się z powierzchnią ciał stałych. Wiążą CO2 korzystają z energii utleniania azotynów do azotanów są względnymi autotrofami, zdolnymi do wzrostu heterotroficznego. Wolny amoniak silnie hamuje chemosyntezę. Już stężenie 0,001M NH3 obniża intensywność procesu o 70%. Wydajność chemosyntezy tych mikroorganizmów jest również niewielka i wynosi od około 2 do 11%. Analogicznie do Nitrosomonas i Nitrosospira również i te bakterie są zdolne do anabiozy. Obydwie grupy bakterii występują zawsze razem ponieważ produkt działania bakterii rodzaju Nitrosomonas i Nitrosospira jest substratem dla rodzaju Nitrobacter i Nitrococcus. [3,4].
Ogólny przebieg nitryfikacji można przestawić za pomocą dwóch reakcji[5]:
Etap I : NH4++ 2O2 →NO2–+ 2H2O (Nitrosomonas , Nitrosospira.)
Etap II : NO2– + 1/2O2 →NO3–(Nitrobacter, Nitrococcus)
Znaczenie tlenu w procesach nitryfikacji.
Bakterie nitryfikacyjne to bakterie aerobowe (tlenowe) wymagają do prawidłowego i nie zakłóconego metabolizmu dostępu do tlenu. Na 1g azotu amonowego utlenionego do azotanów zostanie zużyte 4,5g tlenu, dlatego też stężenie tlenu w wodzie musi być zawsze na odpowiednio wysokim poziomie. Co prawda stechiometryczne potrzeba 4 razy więcej tlenu do reakcji w etapie I niż w etapie II. Jednak o ile w wodzie do reakcji etapu I wystarcza stężenie O2 na poziomie około 2mg/l, to aby zaszła reakcja etapu II stężenie tlenu musi być prawie dwukrotnie wyższe[6,9].
pH a szybkość nitryfikacji.
Odczyn wody powinien zawierać się w przedziale pH 5-7,5. Nitryfikacja ustaje całkowicie przy pH 4. Przebieg nitryfikacji zmienia się wraz ze zmianą pH, przemiany azotu przy różnych wartościach pH przedstawiają wykresy[7]:
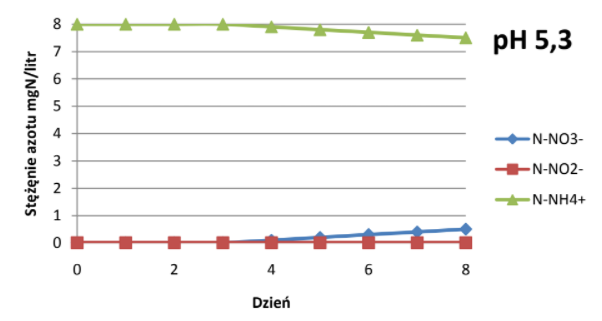
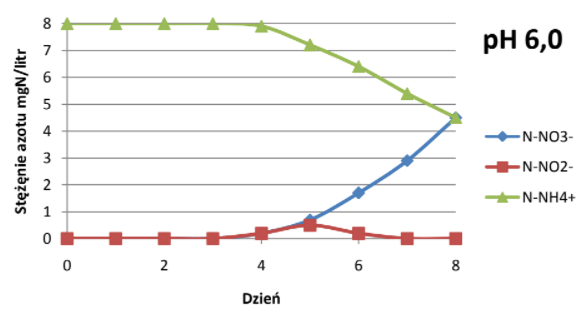

Znaczenie temperatury.
Bakterie nitryfikacyjne to organizmy mezofilne, więc optimum temperaturowe leży w przedziale 28- 36oC jednak w warunkach temperaturowych najczęściej spotykanych w akwariach domowych (19- 28oC) procesy przebiegają prawie tak samo efektywnie. W temperaturze poniżej 5oC i powyżej 40oC nitryfikacja nie zachodzi.[6].
Inne czynniki wpływające na metabolizm bakterii nitryfikacyjnych
Do prawidłowej nitryfikacji niezbędna jest również dostateczna ilość w wodzie i podłożu dostępnego fosforu, wapnia, magnezu, żelaza, manganu, miedzi i innych makro i mikroskładników. Na inhibicję procesu nitryfikacji wpływa m.in. obecność w środowisku substancji biobójczych np. antybiotyków, metali ciężkich oraz duże nagromadzenie związków organicznych na bazie węgla. Nitryfikanty są wrażliwe na działanie światła w szczególności chodzi tutaj o promieniowanie ultrafioletowe. Pod wpływem ultrafioletu, komórki bakterii ulegają stopniowemu uszkodzeniu, jeśli jednak ekspozycja nie była zbyt długa to komórki mają zdolność regeneracji. Bakterie nitryfikacyjne wykazują dużą tolerancję na małe i duże zasolenia wody (duże ciśnienie osmotyczne), organizmy te odporne są również na zmiany stężenia soli nawet w krótkim okresie czasu. [4,8,9].
[1]J.I. Prosser, „Autotrophic Nitrification in Bacteria” Advances in Microbial Physiology Volume 30, 1990, Pages 125-181. [2] Otis F. Daniel G. Curtis Clark „Wstęp do fizjologii roślin” PWRiL 1958. [3] Zurzycki J. Michniewicz M. „Fizjologia roślin” PWRiL 1979. [4] Kunicki-Goldfinger W. J. H. : Życie bakterii. PWN 1998. [5] Richter G. „Procesy metaboliczne u roślin” PWN 1975. [6] dr inż. Joanna Jeż – Walkowiak, mgr inż. Łukasz Weber „Usuwanie jonu amonowego z wody podziemnej”, 2008. [7] Thi Thu Huyen Le, Joachim Fettig, Günter Meon, „Kinetics and simulation of nitrification at various pH values of a polluted river in the tropics” Ecohydrology & Hydrobiology 19 (2019) 54–65 [8] Lityński T. Jurkowska H. „Żyzność gleby i odżywianie się roślin” PWN 1982. [9] Alleman J. E. „Behavior and Physiology of Nitrifying Bacteria” , Purdue University West Lafayette, Indiana.