1.Wstęp.
Fotosynteza u wszystkich glonów i roślin wyższych odbywa się w obecności chlorofilu a; wyjątek stanowią bakterie fotosyntetyzujące zawierające barwniki o nieco odmiennej budowie niż chlorofil a. U roślin występują także inne odmiany chlorofilu. |
Rośliny wyższe i zielenice zawierają chlorofil a i b, natomiast u sinic i niektórych krasnorostów stwierdzono jedynie chlotofil a. Inne gatunki krasnorostów zawierają chlorofil a i niewielką ilość chlorofilu d, a brunatnice i okrzemki mają zarówno chlorofil a, jak i chlorofil c.
Ponadto w fotosyntezie biorą udział inne barwniki, jak karotenoidy, a u krasnorostów i sinic barwniki fikobilinowe (fikoerytryna i fikocyjanina).W tabeli 1. podano wykaz barwników występujących w różnych fotosyntetyzujących organizmach, z uwzględnieniem ich barwy, głównego maksimum absorpcji. Natomiast na rys. 1 przedstawiono podstawowe struktury chemiczne niektórych barwników fotosyntetycznych..
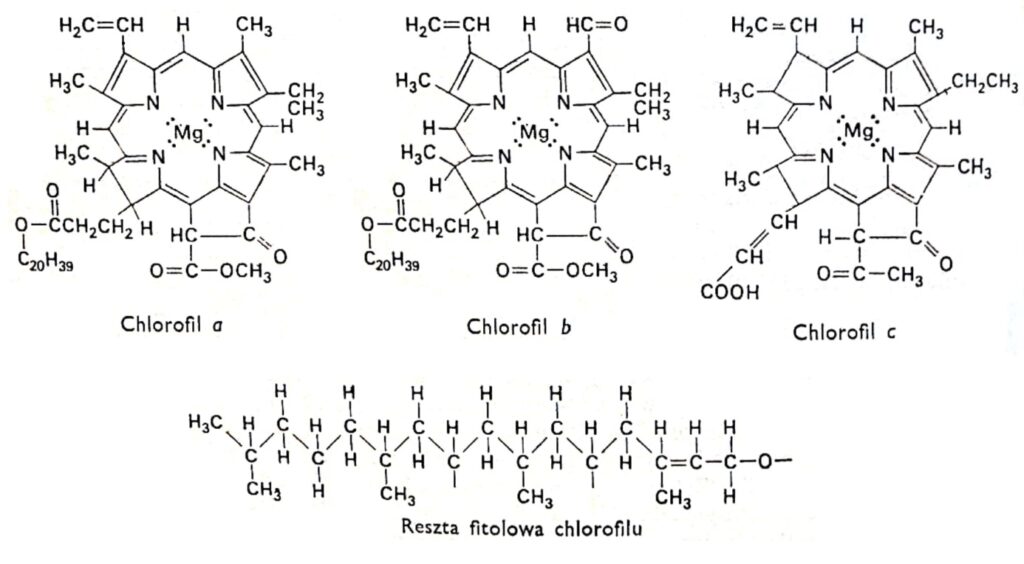
Rys. 1. Wzory strukturalne chlorofilów.
Tab. 1. Właściwości barwników fotosyntetycznych.
Barwnik | Barwa | Główne szczyty absorpcji zakresie widzialnym (nm) |
| Chlorofil a | niebieskozielona | 430 (niebieskofioletowa) 660 (czerwona) |
| Chlorofil b | zielona | 455 (niebieska) 640 (pomarańczowoczerwona) |
| Fikocyjaniny | niebieska | 560-660 (żółta do pomarańczowoczerwonej) |
| Fikoerytryny | czerwona | 550-570 (zielona do żółtej) |
| Karotenoidy | Żółta, pomarańczowo-czerwona | 430-490 (fioletowa do niebieskozielonej) |
2. Budowa chlorofilu.
Wszystkie odmiany chlorofilu mają taką samą strukturę porfirynową, złożoną z czterech pierścieni pirolowych, połączonych z magnezem poprzez występujące w nich atomy azotu. Ponadto w cząsteczce chlorofilu występuje piąty pierś cień zbudowany wyłącznie z atomów węgla i połączony z typowym dla większości chlorofili, z wyjątkiem chlorofilu c, długołańcuchowym alkoholem-fitolem. Chlorofile różnią się między sobą budową bocznych łańcuchów związanych z pierścieniami pirolowymi. Różnica między chlorofilem a i b polega na tym, że trzeci pierścień chlorofilu a zawiera grupę metylową, natomiast w chlorofilu b w tym miejscu występuje grupa aldehydowa. Grupa aldehydowa nadaje chlorofilowi b charakter bardziej hydrofilowy (jest rozpuszczalny w 92% alkoholu metylowym) w porównaniu z chlorofilem a (łatwiej rozpuszczalny w eterze). Ogromna większość roślin zawiera dwu lub trzykrotnie więcej chlorofilu a niż chlorofilu b. Budowa cząsteczki chlorofilu została ustalona na początku naszego stulecia przez niemieckich badaczy R. Wilstattera i A. Stolla oraz sławnego chemika-organika, Hansa Fischera.
Chlorofile a i b pochłaniają głównie światło niebieskofioletowe i czerwone oraz
w niewielkim tylko stopniu światło zielone. Dla chlorofilu a maksimum absorpcji przypada w zakresie światła fioletowego, a więc przy krótszych długościach fal niż dla chlorofilu b; natomiast w zakresie światła czerwonego maksimum jest przesunięte w kierunku fal dłuższych. “Położenie maksimum absorpcji zależy od rozpuszczalnika, w którym rozpuszczone są barwniki, tzn. od rodzaju cząsteczek rozpuszczalnika, z którymi są zasocjowane cząsteczki barwnika, np. w żywej roślinie, główny szczyt absorpcji chlorofilu a w zakresie czerwieni wynosi 683nm, czyli jest przesunięty w stosunku do szczytu przy 660nm dla tego chlorofilu rozpuszczonego w eterze etylowym. Dla chlorofilu a stwierdzono także dodatkowy szczyt absorpcji przy 672nm. Przypuszcza się zatem, że jest to wynik nieco zmienionych warunków środowiska. Wykresy przedstawiające zależność pochłaniania światła od różnych długości fal noszą nazwę widm absorpcyjnych Widno absorpcyjne wyznacza się za pomocą spektrofotometru, tj. przyrządu wyposażonego w źródło światła, które emituje fale o pożądanych długościach; w pryzmat lub siatkę dyfrakcyjną, które służą do rozszczepienia światła; zwierciadła, które odbijają wybrane długości fal i kierują je na badaną próbkę oraz w detektor, służący do wykrywania ilości światła pochłanianego przez badaną próbkę. Naświetlany roztwór chlorofilu silnie fluoryzuje, emitując światło o barwie intensywnie czerwonej. Ponieważ w żywych roślinach większość energii wywołującej fluorescencję zużywana jest w procesie fotosyntezy, dlatego też nie fluoryzują one w widoczny sposób.
3. Synteza chlorofilu.
Synteza chlorofilu jest uzależniona od szeregu czynników obejmujących cechy genetyczne, światło oraz dostępność niektórych pierwiastków mineralnych. U pewnych odmian kukurydzy i słoneczników część kiełkujących nasion tworzy siewki pozbawione chlorofilu. Jest to wrodzona cecha recesywna. Kiełki te, zwane albinosami zamierają wraz z wyczerpaniem się zapasów pokarmowych w nasieniu. Jeśli jednak roślinom takim dostarcza się cukry jako źródło energii, to wówczas mogą one rosnąć prawie do okresu dojrzewania.
Światło jest koniecznym czynnikiem do syntezy chlorofilu prawie u wszystkich roślin okrytonasiennych, jakkolwiek drzewa iglaste, mchy, niektóre paprocie i liczne glony mogą wytwarzać ten barwnik również w ciemności. Rośliny okrytonasienne rosnące bez dostępu światła, syntetyzują niewielkie ilości zielonego barwnika podobnego do chlorofilu, jednak jego za wartość jest zbyt miska, aby nadać tym roślinom zabarwienie zielone. Po naświetleniu barwnik ten zanika, natomiast pojawia się chlorofil a, którego ilość wzrasta, wraz z upływem czasu. Zanikający barwik nazwano protochlorofilem. Chemicznie różni się on od chlorofilu a tylko brakiem dwóch atomów wodoru w cząsteczce. Ponadto podobnie pochłania światło niebieskie i czerwone, wykazując maksima absorpcji przy długości fal 450nm i 650nm. Te długości fal świetlnych są najbardziej efektywne w procesie przekształcania protochlorofilu w chlorofil a. Natomiast zagadnienie pochodzenia chlorofilu b pozostaje nadal nie wyjaśnione.
Wydaje się, że w syntezie chlorofilu uczestniczy bezpośrednio szereg pierwiastków mineralnych, ponieważ ich niedobór powoduje u roślin odbarwienie, czyli chlorozę. Pierścienie pirolowe chlorofilu powstają w wyniku uprzedniego połączenia glicyny z kwasem bursztynowym. Pomiędzy reakcją tych dwóch związków a reakcją końcową utworzenia tak złożonego związku, jakim jest chlorofil, istnieje szereg reakcji pośrednich katalizowanych przez specyficzne enzymy. Reakcja pomiędzy glicyną i sukcynylo-CoA uwarunkowane jest obecnością żelaza jako koenzymu, a niedobór tego pierwiastka powoduje w młodych rozwijających się liściach gwałtowną chlorozę. Niedobór manganu, potasu, cynku i miedzi również wywołuje chlorozę, lecz rola tych pierwiastków jest dotąd niezrozumiała. Przypuszczalnie aktywują one niektóre enzymy biorące udział w syntezie chlorofilu. Niedobór manganu prowadzi do zniszczenia wewnętrznej lamellarnej budowy chloroplastów i może być powodem zahamowania syntezy chlorofilu stabilizującego lamelle.
Natomiast brak azotu i magnezu powoduje żółknięcie roślin. Rola tych pierwiastków jest zrozumiała, ponieważ stanowią one podstawowe składniki strukturalne chlorofilu. Nie wyklucza to również ich bardziej pośrednich funkcji, np. magnez działa prawdopodobnie jako koenzym jednego lub kilku etapów syntezy chlorofilu.
4. Budowa i Synteza barwników karotenoidowych.
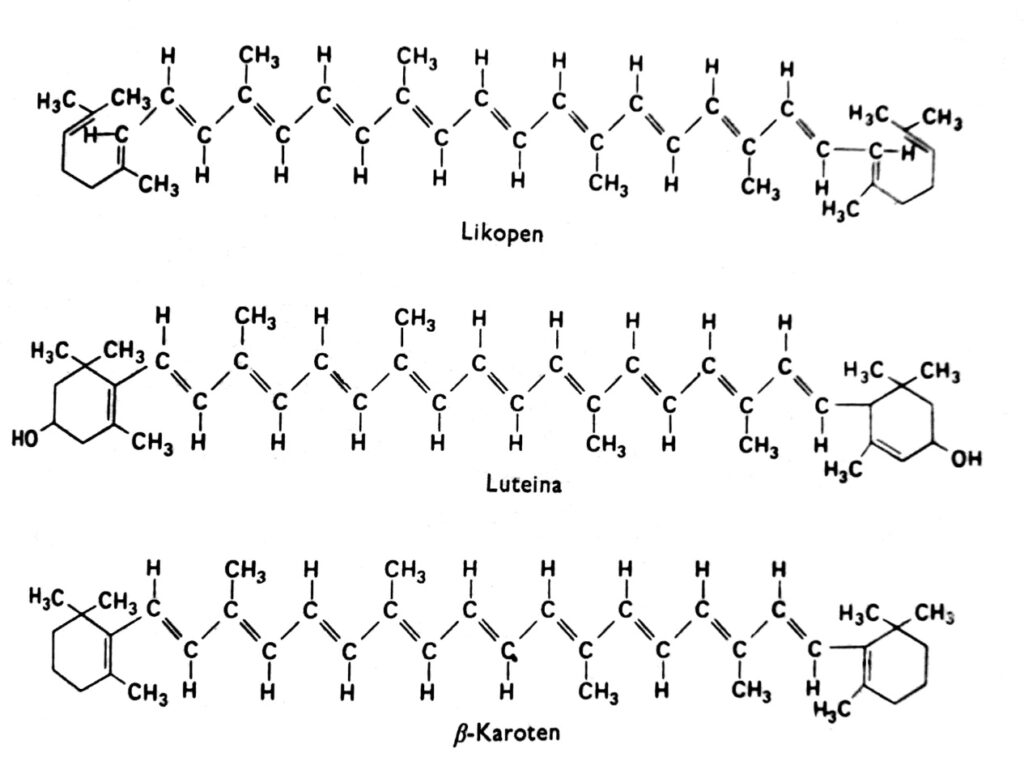
Karotenoidy są grupą barwników, które u roślin wyższych mają na ogół zabarwienie czerwone, pomarańczowe, żółte lub brązowe i występują w chloroplastach w połączeniu z chlorofilem. Niekiedy występują też w innych plastydach, np.: w chromoplastach korzeni marchwi, pomidorów oraz w chromoplastach licznych kwiatów o barwie żółtej. Żółte zabarwienie karotenoidów uwidacznia się u roślin okrytonasiennych rosnących w ciemności i pozbawionych chlorofilu (co wskazuje, że światło nie jest konieczne dla ich akumulacji) oraz na jesieni w liściach wielu gatunków, u których zanika chlorofil. W istocie karotenoidy mogą przejawiać także inne barwy, np. barwę zieloną w owocach awokado, różową – u krewetek lub prawie atramentowo czarną – u głowonogów. Barwniki te występują we wszystkich głównych grupach roślin i zwierząt, lecz przedmiotem naszych rozważań będą przede wszystkim te, które znajdują się w chloroplastach w połączeniu z chlorofilem. Karotenoidy można podzielić na dwie grupy chemiczne: karoteny i ksantofile. W każdej grupie istnieje kilka odrębnych typów tych związków, których cząsteczki są zbudowane z 40 atomów węgla. Karotenoidy, których najważniejszym przedstawicielem jest β-karoten, są węglowodorami rys. 2. Ksantofile jak luteina i zeaksantyna mają atomy tlenu przyłączone do krańcowych pierścieni. Zarówno ksantofile, jak i karoteny w roślinie są syntetyzowane z aktywnego octanu, tj. acetylo-CoA poprzez kwas mewalonowy.
Rys. 2. Wzory strukturalne karotenoidów.
Prawie żaden z karotenoidów nie rozpuszcza się w wodzie, natomiast rozpuszczają się one w wielu rozpuszczalnikach organicznych, np. acetonie i eterze. Ksantofile mając dodatkowe atomy tlenu są bardziej hydrofilowe niż karoteny. W roztworze większość karotenoidów pochłania głównie światło fioletowe i niebieskie w zakresie 400—500nm. Ich widmo absorpcyjne zależy od stopnia wysycenia wiązań podwójnych i dlatego w nie naruszonych chloroplastach może ono być nieco inne. Istnieją dowody, że w nie naruszonej komórce maksima absorpcji niektórych karotenoidów przy 500nm, po ekstrakcji tych barwników rozpuszczalnikiem organicznym, zostają prze sunięte do 450 nm.
5. Funkcje karotenoidów.
Karotenoidy odgrywają istotną rolę w procesie fotosyntezy przypuszczalnie z dwóch powodów:
1. Pełnią funkcję ochronną, zabezpieczając chlorofil przed niszczącym działaniem światła
i tlenu. To destrukcyjne | zjawisko nazywamy fotooksydacją. Często obserwuje się, że alkoholowy roztwór chlorofilu pod wpływem światła ulega odbarwieniu, czemu towarzyszy zużywanie tlenu. Przypuszczalnie podobna reakcja normalnie zachodziłaby w roślinie, gdyby karotenoidy nie spełniały swej funkcji ochronnej. Najbardziej przekonującego dowodu dostarczają obserwacje nad niektórymi mutantami bakterii, Ponieważ nie zawierają one barwników karotenoidowych – fotooksydacja zachodzi u nich bardzo łatwo. Ponadto znane są mutanty słonecznika albinotycznego, które utraciły zdolność syntetyzowania karotenoidów, lecz nadal wytwarzają śladowe ilości chlorofilu. W tym wypadku wzrost natężenia światła wywołuje dodatkową fotooksydację chlorofilu, a szybkość tego procesu jest równa jego syntezie. Mechanizm, za pomocą którego karotenoidy zabezpieczają chlorofil przed utlenieniem, nie jest wyjaśniony. Przypuszcza się jednak, że to właśnie karotenoidy ulegają fotooksydacji pod wpływem światła, które mogłoby rozkładać chlorofil.
2. Inną prawdopodobną funkcją karotenoidów, a szczególnie ksantofili, jest ich udział w pochłanianiu światła o długościach fal aktywnych w fotosyntezie. Istnieją bezsporne dane, które wskazują, że niektóre karotenoidy jak fukoksantyna (nazywana także fukoksantolem) stwierdzana u brunatnic (np. u morszczynu) biorą czynny udział w fotosyntezie. Dowód ten uzyskano przez porównanie widma absorpcyjnego fukoksantyny z tzw. widmem czynnościowym, czyli widmem działania fotosyntezy. Widmo czynnościowe fotosyntezy jest wykresem obrazującym wydajność fotosyntezy, jako funkcji długości fal świetlnych wywołujących ten proces. Stwierdzono, że u zielenie i roślin wyższych, w fotosyntezie wykorzystane jest również światło zaabsorbowane przez niektóre karotenoidy. W takich wypadkach maksima widma czynnościowego mieszczą się w zakresie światła czerwonego i niebieskiego, w którym najsilniej pochłania chlorofil. Jednak fotosynteza nadal przebiega przy udziale światła niebieskozielowego, przypuszczalnie dlatego, że w tym zakresie są aktywne niektóre karotenoidy. Najbardziej przekonującym dowodem na to, że karotenoidy uczestniczą w fotosyntezie, jest ich zdolność do przeniesienia wzbudzonej energii bezpośrednio na chlorofil a. Jeżeli bowiem roślina jest naproamieniona światłem o długościach fal pochłanianych prawie wyłącznie przez karotenoidy, wówczas obserwuje się czerwomą fluorescencję chlorofilu a. Przypuszcza się, że energia wzbudzenia, uwalniająca się niekiedy w postaci fluorescencji, zwykle jest wykorzystywana jako siła napędowa procesu fotosyntezy.
6. Fikobiliny.
Ostatnią grupą barwników fotosyntetycznych są fikobiliny, występujące u sinic
i krasnorostów. Barwniki te są sklasyfikowane w dwóch grupach: czerwone – fikoerytrymy, oraz niebieskie – fikocyjaniny. Podobnie jak chlorofil zbudowane są z czterech pierścieni pirolowych, przy czym fikobiliny zawierają otwarty układ pierścieni pirolowych, a nie zawierają ani magnezu, ani też reszty fitolowej. W żywych komórkach występują one w połączeniu z ibiałkami i są rozpuszczalne w wodzie. Obydwa typy barwników pochłaniają światło, zużywając je do fotosyntezy. U krasnorostów największa wydajność fotosyntezy przypada w zakresie światła zielonego, ponieważ w tym zakresie fikoerytryna, w przeciwieństwie do chlorofilu, pochłania światło najintensywniej. Podobnie jak karotenoidy, fikobiliny przenoszą wzbudzoną energię na chlorofil a i mogą wywołać jego fluorescencję. Ten sposób przekazywania energii wskazuje, że fikobiliny biorą czynny udział w fotosyntezie, wychwytując fotony, których energia jest zazwyczaj zużywana przez chlorofil a jako siła napędowa fotosyntezy. , Barwniki tego rodzaju jak karotenoidy i fikobiliny, przenoszące energię na odpowiedni akceptor, np. chlorofil a, noszą nazwę barwników pomocniczych. Grupa barwników pomocniczych obejmuje również chlorofile b, c i d, ponieważ pochłaniają one energię świetlną, która z kolei może być przeniesiona na chlorofil a.
Literatura:
-Franck B. Salibury, Cleon Ross „Fizjologia roślin” PWRiL 1975.
-Otis F. Daniel G. Curtis Clark „Wstęp do fizjologii roślin” PWRiL 1958.
-Zurzycki J. Michniewicz M. „Fizjologia roślin” PWRiL 1979.
-Richter G. „Procesy metaboliczne u roślin” PWN 1975.