- Wstęp.

Azot zaliczany jest do pierwiastków biogennych o fundamentalnym znaczeniu dla procesów biologicznych zachodzących w komórkach roślin i zwierząt. Wspólne z węglem, tlenem i wodorem zaliczany jest do podstawowych pierwiastków występujących w składzie tkanek wszystkich organizmów żywych. Azot występuje w licznych związkach organicznych, zarówno w łańcuchowych, jak i pierścieniowych. W roślinach pierwiastek ten wchodzi w skład aminokwasów, peptydów, białek. Jest składnikiem chlorofilu, cytochromu, cytokinin oraz witamin z grupy B. Występuje w również w niektórych metabolitach wtórnych, takich jak alkaloidy, betalainy, olejki gorczyczne czy glikozydy cyjanogenne. Dlatego też niedobór azotu stanowi czynnik silnie ograniczający wzrost i rozwój roślin.
- Problem źródeł azotu.
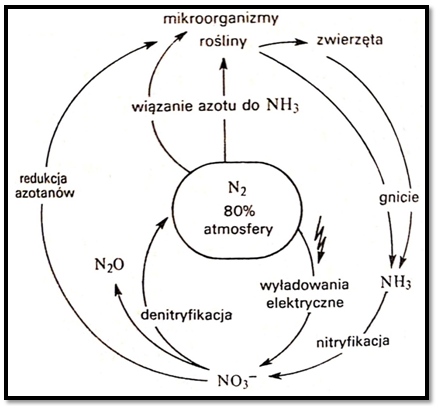
Największym i nieograniczonym źródłem azotu jest atmosfera. Nad każdym hektarem powierzchni unosi się słup powietrza zawierający 80tyś. ton N2. Jednak tylko stosunkowo nieliczna grupa organizmów może korzystać z azotu atmosferycznego. Natomiast olbrzymia reszta roślin może żyć i rozwijać się jedynie dzięki mechanizmowi, który umożliwia im pobieranie azotu od innych organizmów, przede wszystkim z produktów ich rozkładu oraz w niewielkim stopniu z opadów atmosferycznych (tlenki azotu tworzone na wyładowaniach).
Schemat krążenia azotu w przyrodzie.
3. Skutki niedoboru azotu w roślinie.
Do najpowszechniejszych objawów niedoboru azotu, poza zahamowaniem wzrostu części liści i korzeni, zalicza się także przedwczesne opadanie starszych liści. Rośliny nie wytwarzają pędów bocznych. Po przycięciu rośliny nie inicjują stożków wzrostu lub proces ich tworzenia jest mocno spowolniony. Liście roślin rosnących w warunkach niedoboru azotu początkowo stają się jasnozielone, a z czasem uzyskują żółtą barwę w wyniku chlorozy. Rośliny bronią się przed niedoborem azotu poprzez efektywne gospodarowanie posiadanymi zasobami tego pierwiastka. Przed opadaniem liści rośliny resorbują znaczne ilości azotu do młodych i kierują go do tkanek młodych liści.
4. Strategie pozyskiwania azotu przez rośliny.
Jak wynika z powyższych faktów, rośliny muszą pobierać znaczne ilości azotu do prawidłowego rozwoju. W tym celu utworzyły szeroką gamę strategii pozyskiwania tego cennego pierwiastka. Oprócz pobierania azotu w formie nieorganicznej (jony amonowe i azotanowe), rośliny mają umiejętność pozyskiwania azotu z mocznika i aminokwasów. Dodatkowo rośliny mogą uzyskiwać azot dzięki symbiozie z grzybami mikoryzowymi lub bakteriami. Odmienną strategię pobierania azotu wykształciły rośliny owadożerne, tworząc pułapki na owady i po ich schwytaniu trawiąc je z użyciem enzymów wydzielanych z komórek gruczołowych. Tę listę strategii pozyskiwania azotu przez rośliny uzupełnia wykrycie zjawiska wydzielania z korzeni proteaz, które trawiąc białka gleby mogą zwiększać pulę aminokwasów, czyli źródła azotu dla roślin.
5. Nieorganiczne źródła azotu.
Powszechnie uważa się, że rośliny są zdolne do pobierania azotu nieorganicznego pod postacią jonów amonowych (NH4+) i azotanowych (NO3–). Chociaż z energetycznego punktu widzenia jony amonowe są korzystniejszym źródłem, ponieważ nie wymagają redukcji przed wbudowaniem w aminokwasy, to azotany są bardziej dostępne dla roślin. Wynika to z zatrzymywania jonów amonowych w kompleksie sorpcyjnym podłoża ze względu na dodatni ładunek NH4+. Z kolei jony azotanowe nie są wiązane przez ujemnie naładowane kompleksy gleby i dlatego nie pozostają w podłożu. Ponadto rośliny nie preferują jonów amonowych, gdyż mogą one w wysokich stężeniach mieć negatywny wpływ na wzrost korzenia i pędu. Pobieranie NH4+ jest powiązane z wydzielaniem protonów do podłoża, co powoduje jego zakwaszenie i jednoczesny spadek pobierania kationów. Pomimo tego, że istnieją międzygatunkowe różnice w preferencjach pobierania NO3– i NH4+, to prawidłowy wzrost roślin zapewnia obecność obu źródeł azotu nieorganicznego. Azotany wymagają redukcji przed wbudowaniem w aminokwasy. Redukcja azotanu do amonu odbywa się w wyniku stopniowego przyłączania do azotu po 2 elektrony . Cały ten proces zachodzi więc w czterech etapach:
(NO3–) N5+ 2ē→ N3+ 2ē→N1+ 2ē→N1-2ē→N3- (NH4+)
Do tej pory wykryto tylko dwa enzymy uczestniczące w tym szlaku reakcji: reduktazę azotanową, katalizującą przejście azotanu do azotynu (pierwszy etap) i reduktazę azotynową katalizującą redukcję azotynu do amonu. Przypuszcza się też, że katalizuje również przebieg pozostałych trzech etapów. Reduktaza azotanowa u roślin niższych i wyższych występuje w cytoplazmie podstawowej. W skład aktywnego kompleksu tego enzymu o masie cząsteczkowej około 50 000 wchodzą również NADH (Dinukleotyd nikotynoamido- adeninowy), FAD(Dinukleotyd flawinoadeninowy), Mo (molibden) oraz Fe (żelazo). Induktorem syntezy reduktazy jest azotan (substrat). Ponadto wykazano, że enzym ten podlega dość intensywnemu procesowi odnowy.
Pierwszy etap redukcji azotanów można więc przedstawić ogólnie w następujący sposób:
NO3- NADH+H+, FAD, Mo6+,Fe2+→NO2-+H2O
Redukcja azotynu u roślin zielonych odbywa się w chloroplastach przy udziale zredukowanej ferredoksyny, co oznacza, że proces ten jest ściśle związany z przepływem elektronów podczas fotosyntezy. W komórkach pozbawionych chlorofilu reakcja ta odbywa się w obecności NADPH (Fosforan dinukleotydu nikotynamidoadeninowego), natomiast w układzie in vitro donorem elektronów może być np. zredukowany benzylwiologen. Redukcję azotynu można ogólnie przedstawić równaniem:
NO2- ferredoksy zred.(NADPH)→ NH4+
Powstały w wyżej opisanych reakcjach jon amonowy jest wykorzystywany do aminacji określonych keto kwasów. Dlatego też opisana redukcja została nazwana asymilacyjną redukcją azotanów
6. Zdolność roślin do pobierania form organicznych azotu.
Już w połowie ubiegłego wieku zaobserwowano, że rośliny są zdolne pobierać aminokwasy. W ostatnich kilkunastu latach zagadnieniu pozyskiwania aminokwasów przez korzenie roślin poświęcono wiele prac. Aminokwasy mogą być pobierane w relatywnie znaczących ilościach zarówno w warunkach laboratoryjnych jak i w warunkach polowych. Potencjalne znaczenie azotu organicznego pod postacią aminokwasów obserwowano w licznych ekosystemach, wliczając w to ekosystemy tropikalne, stepy w Kolorado, północne lasy iglaste, a także ekosystemy rolnicze. W badaniach na pszenicy wykazano, że także rośliny hodowlane mogą pobierać około 20% podawanej glicyny bez uprzedniej mineralizacji. Za pobieraniem aminokwasów w warunkach naturalnych z gleby przemawia także fakt, że ilość nieorganicznego azotu w glebie niektórych ekosystemów nie zaspokaja potrzeb roślin, co wskazuje, że rośliny muszą pobierać także azot organiczny. Badania preferencji roślin i mikroorganizmów w stosunku do różnych aminokwasów dowiodły, że rośliny pobierają glicynę efektywniej niż inne, z kolei mikroorganizmy preferują aminokwasy o większej masie molowej. Preferencje mikroorganizmów do aminokwasów innych niż glicyna mogą wynikać z faktu, że ten aminokwas jest gorszym źródłem węgla, co powoduje, że mikroorganizmy mogą „pozostawiać” właśnie glicynę dla roślin. Według badań, rośliny mogą pobierać większą ilość aminokwasów w warunkach ich wysokich stężeń w glebie. Należy także pamiętać, że gleba nie jest homogenna pod względem stężenia azotu organicznego. Istnieją obszary o zwiększonej ilości azotu organicznego, które powstały w wyniku śmierci zwierząt lub lizy komórek korzeni. Dodatkowo, także nawozy organiczne dostarczają szczególnie duże ilości związków organicznych. W obszarach bogatych w związki organiczne, ich stężenie może przewyższać zapotrzebowanie mikroorganizmów na to źródło azotu, dając roślinom zwiększony dostęp do tych związków. Kolejnym źródłem azotu dla roślin jest mocznik, który w glebie ulega hydrolizie katalizowanej przez ureazę wydzielaną przez mikroorganizmy. Mocznik przekształcany jest do jonów amonowych, a następnie zostają utlenione do azotanów w wyniku procesu nitryfikacji. Rośliny nawożone mocznikiem uzyskują dostęp zarówno do mocznika, jonów amonowych oraz azotanowych. Mocznik może być pobierany nie tylko z podłoża, ale także poprzez liście. Rośliny mogą również pobierać mocznik w formie niezmienionej i dopiero w komórkach rośliny za pomocą ureazy konwertowany jest do jonu amonowego, który następnie zostaje wbudowany aminokwasy i białka.
7. Konkurencja o azot nieorganiczny.
Azot nieorganiczny gleby pochodzi z mineralizacji organicznych związków azotowych do NH4+ i następującej po tym nitryfikacji do azotanów. Azotany mogą też powstawać ze związków azotu organicznego w wyniku działania heterotroficznych bakterii i grzybów,
a więc z pominięciem amonifikacji. Uważa się, że mineralizacja i nitryfikacja są czynnikami kluczowymi dla obiegu azotu), a rośliny korzystają z nadmiaru azotu nieorganicznego, który nie został pobrany przez mikroorganizmy. Poparciem dla tej tezy są badania, w których w 24 godziny po podaniu znakowanych 15NH4+ i 15NO3– do gleby większość znakowanego azotu wykrywano w biomasie mikroorganizmów. W badaniach krótkoterminowych (24 godziny) mikroorganizmy pobierały pięciokrotnie więcej NH4+ i dwukrotnie więcej NO3– niż rośliny. Jednak w badaniach długoterminowych to rośliny pozyskiwały większość znakowanego NH4+. Podobnie jak w przypadku konkurencji o aminokwasy, na wynik współzawodnictwa
o azot nieorganiczny ma potencjalny wpływ wiele czynników, między innymi obecność mikorytycznego symbiontu, a także proliferacja korzeni w obszarach o szczególnej zasobności w azot nieorganiczny.
-Bartosz Adamczyk, Mirosław Godlewski „Różnorodność strategii pozyskiwania azotu przez rośliny.” Kosmos Tom59 Numer 1-2 2010.
-Gerhard Richter „Procesy metaboliczne u roślin” PWN 1975.
– Franck B. Salibury, Cleon Ross „Fizjologia roślin” PWRiL 1975.
-Zurzycki J. Michniewicz M. „Fizjologia roślin” PWRiL 1979.
-Otis F. Daniel G. Curtis Clark „Wstęp do fizjologii roślin” PWRiL 1958.
-Anna Nowotna-Mieczyńska „Fizjologia mineralnego żywienia roślin. PWRiL 1965
-Diana Walstad „Rośliny w akwarium. Ekologia roślin wodnych” Oriol 2007
-Kielland, K.,. „Landscape patterns of free amino acids in arctic tundra soils. Biogeochemistry, 31, pp.85–98. 1995
-David A. Lipson,Steven K. Schmidt, Russell K. Monson, “Links between microbial population dynamics and nitrogen availability in an alpine ecosystem” EcologyVolume 80, Issue 5 1999